近年來,大腸直腸癌(colorectal cancer, CRC)的發病率與死亡率持續上升,特別在年輕族群中更為顯著。有效臨床前模型的缺乏,是限制新藥開發效率的主要原因之一。台灣國家衛生研究院(簡稱國衛院)生技與藥物研究所的郭靜娟博士研究團隊,成功運用CRC人源性異種移植模型(Patient-derived xenograft, PDX)開發新型多標靶激酶抑制劑 BPR1J481,展現出其抗癌潛力與臨床競爭優勢。該研究成果已發表於《Pharmacological Research》國際期刊。
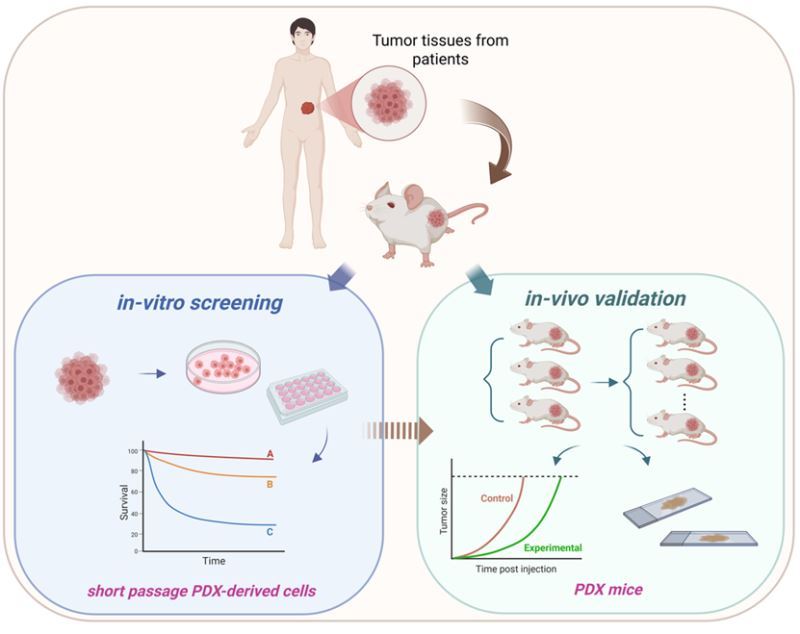
插圖:PDX與藥物開發示意圖 (使用Biorender繪製,郭靜娟老師實驗室提供)
傳統的細胞系異種移植模型(Cell line-derived xenograft, CDX)雖被廣泛應用,但常因缺乏腫瘤異質性與組織結構,往往無法準確預測臨床治療效果。相較之下,PDX模型能較為真實地保留患者腫瘤的組織學與分子特徵,具有較高的臨床預測價值。然而,PDX模型的建立成本高昂、且操作過程繁瑣,限制了其在大規模藥物篩選中的應用。
如何在確保臨床接軌性的前提下,有效提升PDX模型的實用性與平台效能,並導入操作更簡便、且具高通量潛力的替代平台,已成為當前癌症藥物開發領域亟需突破的重要課題之一。為解決這一挑戰,國衛院研究團隊採取「體外篩選與體內驗證」的綜合策略:首先,自PDX腫瘤短期培養建立穩定細胞模型,並以此進行高通量藥物篩選;隨後,利用原始的PDX模型進行體內驗證,兼顧效率與準確性。該研究成功建立了兩株CRC-PDX模型(CRC-C008 與 CRC-C015)及其衍生細胞株,皆具穩定性且保留原腫瘤的生物特性。測試結果顯示,BPR1J481在多種CRC-PDX模型中展現出優於市售藥「雷格非尼」(regorafenib)的療效,且在細胞抑制實驗中表現出更高的效能。其主要作用機制包括:
- 抑制腫瘤生長:BPR1J481可有效抑制與腫瘤惡性進展及預後不良相關的SRC訊號傳導,進而抑制癌細胞增殖並誘導細胞凋亡。
- 抗血管新生:BPR1J481透過抑制VEGFR與PDGFR訊號軸,顯著抑制內皮細胞的增殖、遷移與血管管腔形成,展現強效的抗血管新生活性。
本研究充分展示PDX模型及其衍生細胞在體外篩選與體內驗證的互補角色,成功提升新藥開發的效率與精準性。此研究結果亦反映了替代方法與動物減量的理念,強化PDX策略在精準醫療與臨床前創新模型開發中的重要性,為未來發展具臨床預測力的替代實驗方法提供可行的方向與實證基礎。
相關連結
- 參考資料:
https://doi.org/10.1016/j.phrs.2024.107556.Advancing precision therapy for colorectal cancer: Developing clinical indications for multi-target kinase inhibitor BPR1J481 using patient-derived xenograft models, Pharmacological Research, Vol. 211, 2025, 107556.
編譯:吳建男 副管理師,鄭獻仁 副研究員
校稿:鄭獻仁 副研究員,郭靜娟 研究員 (國衛院生技藥研所)